|
|
|
|
Neuigkeiten Das Projekt Technik RoboSpatium Unterstützung Stichwortverzeichnis Download Reaktionen Spiele Gadgets Kontakt <<< Redoxreaktion Normalpotential >>> ElektrolyseDissoziationWenn man kleine Sandkörner mit Wasser verrührt, wird das Wasser trübe. Wird das Rühren beendet, beginnt der Prozess der Sedimentation, was bedeutet, dass sich die Sandkörner am Boden des Gefäßes absetzen und das Wasser wieder klar wird. Man kann nach wie vor die Sandkörner am Boden des Gefäßes erkennen. Wiederholt man das Experiment mit Körnern von Natriumchlorid, trübt sich das Wasser nur für kurze Zeit. Beendet man den Rührvorgang, sieht es aus als ob das Natriumchlorid verschwunden wäre und selbst nach einer sehr langen Zeitspanne kann man keine Körner am Boden des Gefäßes erkennen. Natriumchlorid ist eine ionische Verbindung bestehend aus positiv geladenen Natrium Kationen und negativ geladenen Chlorid Anionen mit der chemischen Formel NaCl. Wasser besteht aus Molekülen mit der chemischen Formel H2O: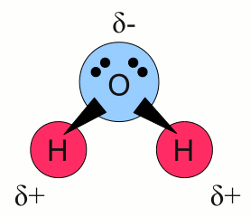 Wasser Molekül:
Wasser Molekül:Wasser Moleküle bestehen aus einem Sauerstoffatom, das zwei kovalente Bindungen mit zwei Wasserstoffatomen bildet. Die beiden Bindungen sind nicht gerade auf einer Linie angeordnet, sondern bilden einen Winkel von ungefähr 104 Grad. Dabei befinden sich die Wasserstoffatome an den Enden und das Sauerstoffatom am Eckpunkt. Weiterhin besitzt Sauerstoff eine höhere Elektronegativität als Wasserstoff, was dazu führt, dass die Elektronen der bindenden Elektronenpaare ungleichmäßig zwischen den beiden Atomen einer Bindung verteilt sind. In der nebenstehenden Zeichnung wird diese Tatsache durch Dreiecke anstelle von Linien zwischen den gebundenen Atomen dargestellt. Aus diesem Grund bildet sich auf der Seite des Sauerstoffatoms eine teilweise negative Ladung und an den Spitzen mit den Wasserstoffatomen eine teilweise positive Ladung. Moleküle mit einer Ladungsverschiebung wie dieser bezeichnet man als Dipole. Die leicht positiv geladen Bereiche der Wassermoleküle werden von dem leicht negativen Bereich anderer Wassermoleküle oder von geladenen Teilchen wie Ionen angezogen. Bringt man einen ionischen Stoff in Wasser ein, so wird der leicht negative Bereich der Wassermoleküle von den Kationen angezogen und die leicht positiv geladenen Bereiche werden von den Anionen angezogen. Die geringe Größe der Wassermoleküle erlaubt es ihnen, die Ionen komplett einzuhüllen. Während dieses Prozesses der Hydratation wird die ionische Bindung eines Salzes wie Natriumchlorid aufgeteilt in einzelne Na+ Kationen und Cl- Anionen, die von dem Kristallgitter weg transportiert werden. Natriumchlorid und Wasser bilden eine wässrige Lösung, wobei Wasser als Lösungsmittel (Solvens) fungiert und Natriumchlorid als gelöster Stoff (Solut). Der Prozess der Trennung der Ionen von ihrem Kristallgitter nennt man Dissoziation. ElektrolyteEine Substanz die frei bewegliche Ionen enthält, nennt man Elektrolyt. Wird Kupferchlorid (CuCl2) in Wasser gegeben, beginnen die Kristalle zu dissoziieren und man erhält eine wässrige Lösung mit Cu2+ und Cl- Ionen, die sich frei zwischen den Wassermolekülen bewegen können. Was passiert, wenn diese Lösung einem elektrischen Feld ausgesetzt wird? Nun, im Kapitel über elektrische Spannung haben wir gelernt, dass eine Kraft auf geladene Teilchen in einem elektrischen Feld wirkt. Etwas später im Kapitel zum elektrischen Strom haben wir gesehen, dass sich geladene Teilchen in einem elektrischen Feld bewegen (so lange diese nicht fixiert sind). Die sich bewegenden Teilchen beziehungsweise die Flussrate der Teilchen bezeichnet man als elektrischen Strom. Wir können die wässrige Lösung von Kupferchlorid einem elektrischen Feld aussetzen, indem wir zwei Platten aus elektrisch leitendem Material an zwei Seiten des Gefäßes platzieren und diese Platten mit einer Spannungsquelle verbinden: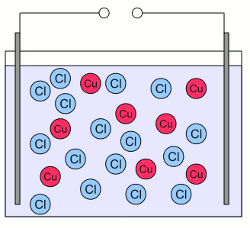 Wässrige Lösung von Kupferchlorid:
Wässrige Lösung von Kupferchlorid:Die massiven Kupferchlorid-Kristalle sind in einzelne, frei bewegliche Cu2+ Kationen (rote Kreise) und die doppelte Anzahl an Cl- Anionen (blaue Kreise) dissoziiert. Kationen und Anionen sind gleichmäßig über das Gefäß verteilt. 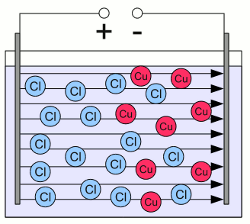 Die wässrige Lösung wird durch zwei elektrisch leitende Platten einem elektrischen Feld ausgesetzt. Die linke Platte ist mit dem Pluspol der Spannungsquelle verbunden und die rechte Platte mit dem Minuspol. Dadurch wird ein elektrisches Feld generiert, das ähnlich dem eines Kondensators ist. Sobald sich das elektrische Feld gebildet hat, wirken Kräfte auf die geladenen Ionen. Die positiv geladenen Kationen werden zur negativ geladenen Platte gezogen, die negativ geladenen Anionen zur positiv geladenen Platte. Als Ergebnis dieser Bewegung sind die Ionen nun ungleichmäßig über das Gefäß verteilt, was ebenfalls zur Ausbildung eines elektrischen Feldes führt, das dem externen Feld der Spannungsquelle entgegen gerichtet ist. Im Gegensatz zu Elektronen, welche in die Platte eintreten könnten, stoppt die Bewegung der Ionen wenn diese die Platten berühren. Sobald das elektrische Feld, das durch die Ionen hervorgerufen wird, das Feld der externen Spannungsquelle ausgeglichen hat, wirken keine Kräfte mehr auf die Ionen und deren Bewegung stoppt.
Die wässrige Lösung wird durch zwei elektrisch leitende Platten einem elektrischen Feld ausgesetzt. Die linke Platte ist mit dem Pluspol der Spannungsquelle verbunden und die rechte Platte mit dem Minuspol. Dadurch wird ein elektrisches Feld generiert, das ähnlich dem eines Kondensators ist. Sobald sich das elektrische Feld gebildet hat, wirken Kräfte auf die geladenen Ionen. Die positiv geladenen Kationen werden zur negativ geladenen Platte gezogen, die negativ geladenen Anionen zur positiv geladenen Platte. Als Ergebnis dieser Bewegung sind die Ionen nun ungleichmäßig über das Gefäß verteilt, was ebenfalls zur Ausbildung eines elektrischen Feldes führt, das dem externen Feld der Spannungsquelle entgegen gerichtet ist. Im Gegensatz zu Elektronen, welche in die Platte eintreten könnten, stoppt die Bewegung der Ionen wenn diese die Platten berühren. Sobald das elektrische Feld, das durch die Ionen hervorgerufen wird, das Feld der externen Spannungsquelle ausgeglichen hat, wirken keine Kräfte mehr auf die Ionen und deren Bewegung stoppt.Die Platten aus elektrisch leitendem Material nennt man Elektroden. Die Elektrode welche an den Minuspol der Spannungsquelle angeschlossen ist, nennt man Kathode, die an den Pluspol angeschlossene Elektrode Anode. In einem Elektrolyten werden die positiv geladenen Ionen (Kationen) zur negativ geladenen Kathode gezogen und die negativ geladenen Ionen (Anionen) zur positiv geladenen Anode. RedoxreaktionWie weiter oben bereits erwähnt, können die Ionen nicht in die Elektroden eintreten. Sobald ein Ion in Kontakt mit einer der Elektroden kommt, werden chemische Reaktionen ausgelöst. An der positiv geladenen Elektrode verlassen Elektronen den Elektrolyten, sobald ein Anion diese berührt. Das Anion gibt ein oder mehrere Elektron(en) ab, was zur Erhöhung seiner Oxidationszahl führt. Das Anion wird also oxidiert. An der negativ geladenen Elektrode (Kathode) nehmen die Kationen Elektronen auf, was zu einer Erniedrigung ihrer Oxidationszahl führt. Die Kationen werden also reduziert. Angewendet auf das obige Beispiel, laufen die folgenden chemischen Prozesse an den Elektroden ab:An der Kathode werden positiv geladene Kupferionen zu elementarem Kupfer reduziert: An der Anode werden negativ geladene Chloridionen zu Chlormolekülen oxidiert: Die von den Anionen zur Anode transportierten Elektronen verlassen dort den Elektrolyten. Anschließend werden diese von der Spannungsquelle zur Kathode "gepumpt". Dort treten die Elektronen wieder in den Elektrolyten ein, indem diese auf die Kationen übertragen werden. Damit ist der elektrische Stromkreis geschlossen und ein permanenter Strom fließt durch den Elektrolyten. Dieser Prozess wird Elektrolyse genannt. Die Leitfähigkeit eines Elektrolyten hängt von der Anzahl und der Beweglichkeit der Ionen, sowie von deren Ladung ab. Während ein elektrischer Strom durch den Elektrolyten fließt, wandeln sich die Ionen durch Elektronenaufnahme oder -abgabe in ungeladene Atome und werden damit dem Elektrolyten entzogen. Somit sinkt die Anzahl der Ionen und damit auch die Leitfähigkeit des Elektrolyten. <<< Redoxreaktion Normalpotential >>> Neuigkeiten Das Projekt Technik RoboSpatium Unterstützung Stichwortverzeichnis Archiv Download Reaktionen Spiele Verweise Gadgets Kontakt Impressum |
|
|